���q�����w�|�y�f
�y�f�ɂ��ĊT���ł���
�����̔����i���̓��ɂ����鉻�w�����j�̐G�}�����̐G�}
�@����������̔����̂��ꂼ����A�ʁX�̍y�f���S�����Ă���B
�y�f�̕����I��Ղ�����ł���
���قƂ�ǂ̍y�f�������^���p�N�������A���ɂ�RNA�̂��̂�����A
RNA�y�f�����{�U�C���Ƃ����B
�y�f�̕��ޖ@�̌���������ł���
���y�f�͐G�}���������l���ɂ��A6�̑啪�ނɕ�������B
�@���̕��ނɏ]�����R�[�h�i���o�[�ɂ�閽���@�����邪�A�Â�����g���Ă������p�������ł���ʓI�ɗp�����Ă���B
�������́A������x���̍y�f�̐����⑮����������悤�ɖ��Â���ꂽ���p���̂��ƁB
�������A�y�v�V���Ȃǂ̌Â����p���́A���̂܂��������ƂȂ��Ă���B
�y�f��6�̑啪�ނ�����ł���
���@�_���Ҍ��y�f�i�_���Ҍ���������y�f�j
�@�A�]���y�f�i�H�H�H�j
�@�B���������y�f�i����������������y�f�j
�@�C�����t���y�f�i�@�B�ȊO�̕��@�ɂ�镪�q�̐ؒf��������y�f�j
�@�D�ِ����y�f�i�V�X�g�����X�ALD�A�A���f�q�h�P�g���Ȃǂ̑��ݕϊ���������y�f�j
�@�E�����y�f�i2�̕��q�̌�����������y�f�j
�y�f�̐G�}��p���G�l���M�[�̊ϓ_��������ł���
���y�f�i�G�}�j���������G�l���M�[��������i�J�ڏ�������艻������j���Ƃɂ��A
�@�������x�����߁A���̓��ɂ����Ď��p�I�ȑ����ɂ��Ă���B
�@�Փ˗��_�ɂ��A�������x���グ��ɂ�4�̕��@������A�������G�l���M�[����������@��
�@���̒���1�ł���B
�@�܂��A�������x�����t�Ƃ͊W���Ȃ��B����́A���t���u���������v�Ɓu�������̔Z�x�v�Ɉˑ����Ă��邽�߂ł���B
�y�f�����̕\���@������ł���
���y�f�����̌����P�ʂ��u�J�^�[���ikatal�Akat�j�v�A
��b��w�E��w����Ŏg����P�ʂ��u���ےP�ʁE���j�b�g�iU�j�v�Ƃ����B
�܂��A�䊈���Ƃ́A�^���p�N��1mg�̊����i������kat��������U�ŕ\���j�̂��ƁB
�y�f��⏕���镨��������ł���
���y�f�ɂ͒P���y�f�ƕ����y�f��2��ނ�����A�����y�f�̍y�f�{�̈ȊO������q�Ƃ����B
�@����q�̒��ł��A�L�@����q����y�f�ƁA�����C�I�����܂�����q�������y�f�Ƃ����B
����ِ����T���ł���
���قƂ�ǂ̏ꍇ�A1�̍y�f��1�̊�i�G�}��p���锽�����j�ɐꑮ�i���ٓI�j�ł���A
���������ِ��i���ƌ����̊W�j�Ƃ����B
���ƌ����������A�y�f-����������ł���B
�܂��A�y�f�͗��ِ̈��̂����ʂ��邽�߂ɁA���̓��ٓI�ł���Ƃ�������B
�������ʂ̊T�O������ł���
���y�f�ɂ����������Ƃ������̂�����A����������������������G�}��������Ȃ�B
�@����������̓L�����ł��邽�߂ɁA�G�i���`�I�}�[��W�A�X�e���I�}�[�������ł���B
�@�܂��A�������f���Ƃ́A�y�f�������������`��ς��Ȃ����Ƃ������A
�U���K�����f���Ƃ́A�y�f��������������̌����ɔ����Č`��ς��邱�Ƃ������B
�œKpH�̈Ӗ��A�����A��O�ɂ��Đ����ł���
���y�f�̊�����pH�ɂ���ĕς�遁pH�ˑ���
�قƂ�ǂ̍y�f�͒����t�߂ōł����������������A������œKpH�Ƃ����B
�@����́A�ɒ[��pH�ł̓^���p�N���ł���y�f�̗��̍\�������Ă��܂�����ł���B
�@�A�V�h�[�V�X���A���J���[�V�X���댯�Ȃ̂́A������pH��������A
�y�f���j��Ă��܂����Ƃɂ��B
��O�Ƃ��āA�ݓ����̍y�f�y�v�V�������\�\�[�����̍y�f�͎_�����œKpH�������A
��ܒ��̃^���p�N�������y�f�̓A���J�������œKpH�����B
�œK���x�̈Ӗ��A�����A��O�ɂ��Đ����ł���
�����x�ɂ���Ă��y�f�����͕ς�遁���x�ˑ���
�@�قƂ�ǂ̍y�f���œK���x��45�����x�ł��邪�A�����荂���Ȃ�Ƌ}���Ɋ����������B
�@����́A�^���p�N�����M�ϐ��̂����ł���B
�@��O�Ƃ��āA����ɑ��݂����D�M���͍œK���x��100���߂��ϔM���y�f�����B
�y�f�������x�_���T���ł���
�~�J�G���X�|�����e���^�������x�_��������уO���t�Ɋ�Â��Đ����ł���
���܂��A�y�f�����͎��̂悤�ȉ��w�������ŋN����B
�@�����ŁAS�͊�AE�͍y�f�AES���y�f-��������AP�͐�������\���B
�@�@�@
�����āA�y�f�������x�̓~�J�G���X�|�����e���̎��ŕ\�����B
��0�͔����̏����x�A[S]�͊�Z�x�AVmax�͍y�f�̍ő叉���x�AKm�̓~�J�G���X�萔�B
�~�J�G���X�萔��Vmax/2�̎���[S]�̒l�B
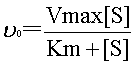
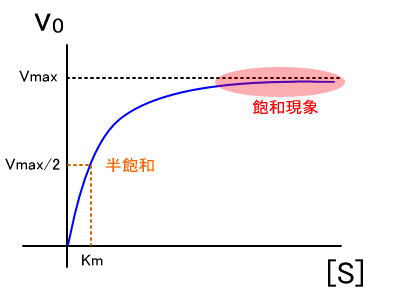
������A�O���t�ɂ���ƁA���̂悤�ȋȐ���������B
Vmax�͍y�f�̌��E�\�͂ł���̂ŁA�������x�������ɋ߂Â��ƁA
[S]�𑝂₵�Ă��������x�͕ς��Ȃ��Ȃ�B������O�a�����Ƃ����B
�i�܂�A�O�a����܂ł́A��Z�x�ˑ����ł���Ƃ�����B�j
�܂��A�~�J�G���X�萔����Vmax/2�����O�a�Ƃ����B
�@�@
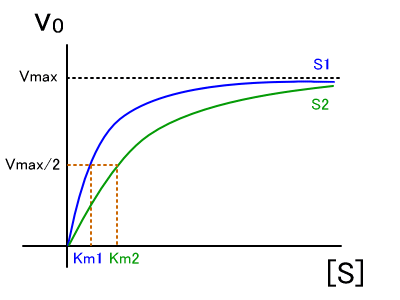
�@�܂��A�Ȑ��͊�ɂ���ĈقȂ�B
�@���̃O���t�̏ꍇ�A�y�f�Ƒ������ǂ��̂�S1�ł���B
�@�܂�AKm���傫�������y�f�Ƃ̐e�a�����Ⴂ�i���y�f�������������j�ƌ�����B
�@�@
���~�J�G���X�萔Km��ES�����̂��𗣒萔�i���t�萔�jK�̋ߎ��l�ł���B
�@�@
�@K�͏�̎��ɂ����āAS+E��ES�Ƃ̊Ԃ��𗣒萔�i���t�萔�j�ł���̂ŁA
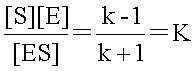 �@�ƕ\����B
�@�ƕ\����B
�@����A�~�J�G���X�萔Km�́A�����S�̒���ES�����������t�萔�ł���̂ŁA
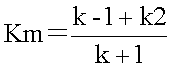 �ƕ\����B
�ƕ\����B
�@�������Ak2<<k-1�ł��邽�߁Ak2��0�Ƃ݂Ȃ��ƁA
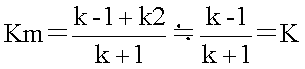 �ƂȂ�B
�ƂȂ�B
���C���E�B�[�o�[�|�o�[�N�̃v���b�g��U�����A�O���t����Km��Vmax��
���߂���@������ł���
���~�J�G���X�|�����e���̎��̋t�����Ƃ�ƁA���̂悤�Ȏ���������B
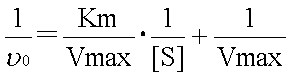
�@������A���C���E�B�[�o�[�|�o�[�N�̎��Ƃ����B
�@���̎��ɂ����āA�ϐ��̓�0��[S]�A�萔��Km��Vmax�ł���̂ŁA
�@1�����i����ax+���j���������ƍl���邱�Ƃ��ł���B
�@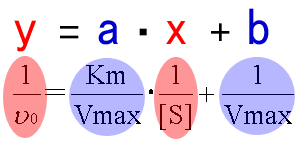
�@���̎��̗��_�́A�O���t�������œ����鏊�ł���B
�����ɂ����āA�v���b�g�����_����́A�Ȑ���蒼���̕����`���₷�����߁A
�~�J�G���X�|�����e���v���b�g��胉�C���E�B�[�o�[�|�o�[�N�v���b�g�̕����g����B
�i���C���E�B�[�o�[�|�o�[�N�v���b�g����d�t���v���b�g�Ƃ��Ă��B�j
�܂��A�O���t�́Ay�ؕЂ����Vmax���Ax�ؕЂ����Km���ȒP�ɓ�����B
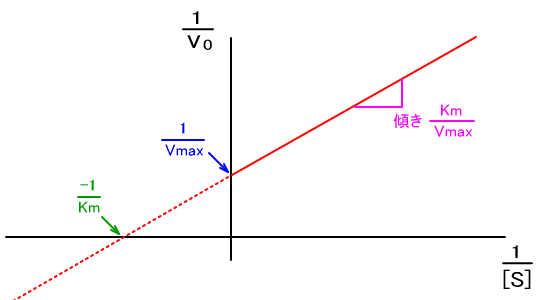
Km��Vmax�����߂邱�Ƃ̈Ӌ`������ł���
���y�f�ɂƂ��Ă�Km��Vmax�́A���w�����ɂ��Ă̗Z�_�╦�_�̂悤�Ȃ��̂ł���A
�@�y�f�̓�����\���B
�@�܂��AKm��Vmax���킩��A�������x��G�}���������킩��A
�����@�\�i�y�f�̐G�}�@�\�j�̗����ɂ��Ȃ���̂ŁA
���i�̊J�����̍y�f�𗘗p���������ɕK�v�ł���B
�y�f�j�Q�ɂ��ĊT���ł���
���y�f�j�Q�܂Ƃ́A����y�f�̍�p����ٓI�ɑj�Q���镨���̂��ƂŁA����ٓI�ɑj�Q������͍̂y�f�j�Q�܂Ƃ͌���Ȃ��B
�@�y�f�j�Q�́A�Ƃ��ėp�����邱�Ƃ����邪�A�̓��ł������I�ɋN���邱�Ƃł���A
�@���̒��߂�̖h�����̂��߂ɓ����Ă���B
�@�܂��A�Ƃ��čy�f�j�Q�܂��g�����ƂŁA�����@�\�𗝉��ł��邱�Ƃ�����B
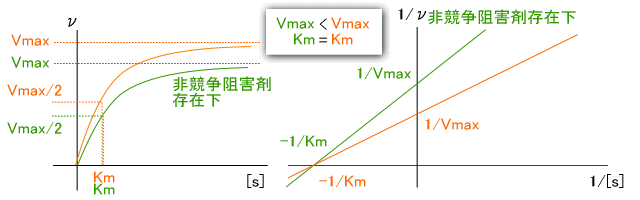
�����j�Q�܂̍�p�@�\�A�������x�_�ւ̉e��������ł��A����������邱�Ƃ��ł���
�������j�Q�܂́A���̂悤�ɁA��ƍy�f�������������߂����ĒD�������i����Ƃ̋����j
���ƂŁA�y�f������̂̐�����W����B���̂��߁A�����j�Q�܂Ɗ�̔�ɂ����
�y�f�\�͂��ς��B
�@�������x�_�Ƃ��ẮAKm���傫���Ȃ邪�AVmax�͕ς��Ȃ��B
�@�܂��A�����j�Q�܂̋�̗�ɂ�AZT������BAZT�̓G�C�Y���Ö�ŁAHIV�̋t�]�ʍy�f��
�j�Q����B
���j�Q�܂̍�p�@�\�A�������x�_�ւ̉e��������ł��A
����������邱�Ƃ��ł���
�����j�Q�܂́A���̂悤�ɁA�y�f�̊������ʂł͂Ȃ������ɍ�p���邱�ƂŁA
�y�f�̔\�͂�������B
�܂��AES�ɂ�������ESI�ƂȂ邱�Ƃōy�f�\�͂������Ƃ��ł��邽�߁A
�����j�Q�܂Ƃ͈Ⴂ�A��Z�x�����߂Ă��y�f�S�̂̔\�͕͂ς��Ȃ��B
�������x�_�Ƃ��ẮAKm�͕ς�炸�AVmax���������Ȃ�B
��̗�́A���i�U�jPb2+�A����i�U�jHg2+���܂ށA�����̏d�����C�I���B
�����j�Q�Ɣ��j�Q���~�J�G���X�|�����e���^�v���b�g�A���C���E�B�[�o�[�|�o�[�N�v���b�g
�łǂ̂悤�ɕ\����邩�����ł���B
�������j�Q�܂̃O���t�́�
�@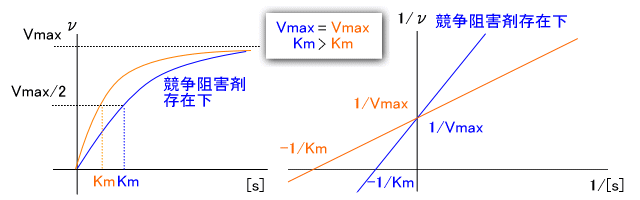
�@���j�Q�܂̃O���t�́�
�@
�A�C�\�U�C���i�C�\�y�f�j�ɂ��ĊT���ł���
������������G�}���邪�A���q�\���̈قȂ�y�f�̂��Ƃ��A�C�\�U�C���i�C�\�y�f�j�Ƃ����B
�@���̂悤�ȓ���������̂́A�قȂ�ꏊ�i�̑��ƐS���Ƃ��j��قȂ�ł��A
�����������N����悤�ɐi���������߂�������Ȃ��B
��̗�ɁA���_�f�q�h���Q�i�[�[������B
�A���X�e���b�N�y�f�ɂ��ĊT���ł���
���A���X�e���b�N�y�f�Ƃ́A���}�̂悤�Ɋ������ʂƂ͕ʂ̏ꏊ�Ɂu�����v�̂���y�f�̂��ƂŁA
�@���́u�����v�̂��Ƃ��A���X�e���b�N���ʂƂ����A�����Ɍ�������u���v�̂��Ƃ��A
�@�A���X�e���b�N�G�t�F�N�^�[�Ƃ����B
�@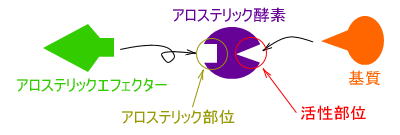
�@�A���X�e���b�N�G�t�F�N�^�[���A���X�e���b�N���ʂɌ����������A
�y�f�\�͂����߂����̒����ƁA��߂����̒���������B
�܂��A��ƃA���X�e���b�N�G�t�F�N�^�[�͑��ݓI�ɓ����������߁A��������������Ƃ����A
�������������̂��߂ɁA�������x�̃O���t�̓~�J�G���X�|�����e���^�ł͂Ȃ��A
�V�O���C�h�Ȑ��iS���^�Ȑ��j�ƂȂ�B