pH(ピーエイチ)とは…
【pH(ピーエイチ)とは…】 水に溶かしているということは、上の式を見てもわかるように、酸性の水溶液 でもアルカリ性の水溶液でも、必ず、H+(水素イオン)がふくまれていることに なる。このH+(水素イオン)の濃度のこさによって酸・中性・アルカリ性となること になる。 このH+(水素イオン)濃度を表す 水素イオン指数をpH(ピーエイチ)という。 pHは、power of Hydrogen ion concentrationの略である。 ドイツ語読みでは、ペーハーとなる。 |
【水の中のH+(水素イオン)について】 水は中性であるが、ごくわずかではあるが電離(でんり)している。 H2O → H+ + OH− 水 水素イオン 水酸化物イオン 上の式のように、水もごくわずかながら、H+(水素イオン)とOH−(水酸化物 イオン)に分かれている。だが、酸性をしめすH+(水素イオン)の数とアルカ リ性を示すOH−(水酸化物イオン)の数が同じであるため、中性を示すのであ る。 酸 性 の水溶液の場合 H+(水素イオン)>OH−(水酸化物イオン) 中 性 の水溶液の場合 H+(水素イオン)=OH−(水酸化物イオン) アルカリ性の水溶液の場合 H+(水素イオン)<OH−(水酸化物イオン) |
【酸性(さんせい)、アルカリ性とpH(ピーエイチ)の関係】 ●酸性(さんせい) pH(ピーエイチ)の値が「7」よりも小さくなると酸性である。 「7」よりも小さいほど、強い酸性となる。 これは水素イオン濃度がだんだん高くなるためである。 ●アルカリ性 pH(ピーエイチ)の値が「7」よりも大きくなるとアルカリ性である。 「7」よりも大きいほど、強いアルカリ性となる。 これは水素イオン濃度がだんだん低くなるためである。 |
| 水溶液1リットル中にふくまれる H+(水素イオン)のグラムイオン数 |
pHの値 | 性 質 | 強 さ |
| 1 =10−0 | 0 | 酸 性 |
酸 性 強 い ↑ ↑ ↑ ↑ ↑ ↑ ↑ 酸 性 弱 い |
| 0.1 =10−1 | 1 | ||
| 0.01 =10−2 | 2 | ||
| 0.001 =10−3 | 3 | ||
| 0.0001 =10−4 | 4 | ||
| 0.00001 =10−5 | 5 | ||
| 0.000001 =10−6 | 6 | ||
| 0.0000001 =10−7 | 7 | 中 性 | |
| 0.00000001 =10−8 | 8 | ア ル カ リ 性 |
アルカリ 性弱い ↓ ↓ ↓ ↓ ↓ ↓ アルカリ 性強い |
| 0.000000001 =10−9 | 9 | ||
| 0.0000000001 =10−10 | 10 | ||
| 0.00000000001 =10−11 | 11 | ||
| 0.000000000001 =10−12 | 12 | ||
| 0.0000000000001 =10−13 | 13 | ||
| 0.00000000000001 =10−14 | 14 |
〈 pH(ピーエイチ)と酸性、アルカリ性の関係を示した表 〉
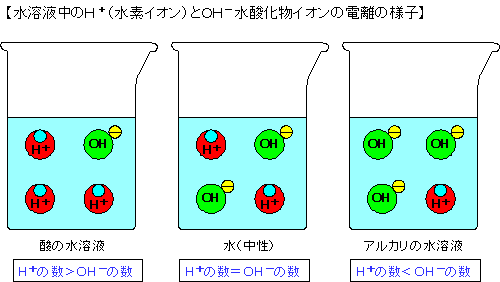
【中性の規定】 純粋(じゅんすい)な水は、1リットルの中にH+(水素イオン)を10−7 (0.0000001)グラムイオンをふくんでいるので、pHを「7」と決め ている。 〈 注 意 〉 |