詳細な説明
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、バチルス・プミルス(Bacillus pumilus)種に属する新規微生物に関するもので、慢性胃炎による胃酸の減少に対して胃液の分泌を促す作用を有する新規微生物、その分泌物組成物及びそれらを使用したプラスミドに関する。
【背景技術】
【0002】
胃潰瘍、十二指腸潰瘍等の消化性潰瘍は、消化液などの内臓壁への攻撃因子抑制剤(胃酸分泌抑制剤、胃酸中和剤、胃酸中和剤等)や防御因子増強剤(粘膜保護剤等)が使用されていた。しかし慢性胃炎、とりわけ無酸性胃炎の患者には胃酸の分泌促進が効果的であると思われるが、生体に無害である胃液促進剤については開発されていないのが現状である。
【0003】
胃潰瘍の原因の1つである細菌ヘリコバクター・ピロリの感染の場合には慢性胃炎を生ぜしめ揚句の果てに潰瘍・癌を誘発させる。すなわち、胃の状態を悪化させる菌であるが、同じ微生物でありながら、胃の状態を改善する微生物は未だ発見されていないのが実情である。
【発明の開示】
【発明が解決しようとする課題】
【0004】
従って、ピロリ菌に対抗できるような胃の調子を改善する微生物の発見が望まれていた。また発見された新規の微生物及びその分泌物を利用した治療剤の製造が課題であった。
【0005】 本発明の新規微生物は、発明者の実験によれば、全くピロリ菌とは逆の環境、すなわち慢性胃炎特に胃酸の減少するタイプの慢性胃炎に対して、胃液の分泌を促進し、慢性胃炎を軽化させるものであり、ひいては、慢性胃炎からの癌や潰瘍を防止するものであると推測される。従って、すべての人の胃や血液から検出され、慢性胃炎、潰瘍、癌、の患者の血液からも検出されることもままある。 胃液分泌促進に有利な特性を有するのみならず、血小板、赤血球、白血球の増加作用も見られるため、多方面の応用が可能となる。
【課題を解決するための手段】
【0006】
バチルス・プミルス種に属する新規微生物(国際寄託番号NITE BP-295)に動物実験の結果胃液分泌促進効果が認められ、しかもLD50 2g以上のため、無害であることも判明したものである。
【0007】
この微生物は形態としては、点状、連鎖状ともあり、大きさは0.5~1μm×10~20μm両端に鞭毛を有し、運動性があり、8字運動をする。芽胞を有し、好気性の高いグラム陽性の桿菌及び球菌である。連鎖状ともなる。分離源はヒトの胃壁あるいは血液となる。あるいは慢性胃炎を生ぜしめるウイルスを受精卵に植え付け対抗して出現する菌を採取しても良い。
【0008】
培養条件は以下の通りである。
培地1000ml(トリプトソーヤブイヨン)当たり
ペプトン 17g
ダイズペプトン 3g
塩化ナトリウム 5g
ブドウ糖 2.5g
リン酸水素カリウム 2.5g
の栄養物を添加し、カセイソーダ3gを加える。pHを8.5に調整する。培地の殺菌条件は121℃ 15分 行い、培養温度は37℃ 培養期間は2から7日となる。
以上の条件で培養した菌の特性は偏性好気性であり、生存確認は肉眼又は顕微鏡下での観察となる。
保管条件は凍結乾燥など、一般に用いられている方法で可能である。
【0009】
このようにして採取した新規微生物は下記の特徴を有する。なお、これらは顕微鏡観察等によるものである。
1 遺伝子配病原細菌を貪食するときにはその抗菌性が強まる。
2 病原細菌により形を変える。
3 代謝産物である分泌物質は、褐色をしている。
4 新規微生物は赤血球を侵さない。(赤血球でいうと普通抗がん剤を用いても赤血球の数が減少せずHb12-16のままであり赤血球が減少していない、C型肝炎なら6ぐらいとなる)。
5 新規微生物は死んだ組織体を清浄化する。
6 新規微生物は放射線、紫外線、微音波に弱い。
7 新規微生物は耐熱性が強く、数時間100℃に耐えることができ、破壊されない。オートクレーブをかけても生きている。
8 赤血球、血小板、白血球の増加を促し、貧血の改善が見られる。(白血球が6000あった患者において抗がん剤の投与後でも500以上の白血球数値認められることからこの菌による増加作用が認められる。血小板は200,000であった患者において、抗がん剤の投与後でも3,000程度にしか落ちないことから、この菌による増加作用が認められる。)
【0010】
この配列は一部配列決定を行い、配列番号1に示す、遺伝子配列を有することが判明している。さらに図2―図4に示すように99%の相同性でバチルス・プミルス種であると判断した。系統樹は図5のようになる。配列の一部が特定できていることで、プラスミド発現ベクターなどへの応用等が可能となり、大量培養やスクリーニング、製薬などにおいて多大の効果が期待できる。
【0011】
分泌物の抽出方法については以下の通りである。まず33~37℃で7日間ブイヨン中で菌を培養する。次に純粋ブチルアルコールを同量この培養濾液に加え良くかき混ぜる。3時間放置或いは遠心分離した後、透明なブチルアルコール溶液を分離する。この溶液に1規定の塩酸を加えpH3.0にし、良くかき混ぜ12時間放置する。次に真空乾燥させると明るい黄色の結晶と有機物質、無機物質が得られる。 ブチルアルコール溶液以外の溶液を活性炭と混入し、よくかき混ぜ1日置く。 活性炭のみをブチルアルコールに加え12時間後ブチルアルコール溶出液を真空乾燥にかける。以下同様に繰り返して結晶を得る。
【0012】
本発明は前記分泌物のアミノ酸配列をコードするようなDNA-配列を有する発現ベクターを含有する、形質転換された微生物を用いる本発明の分泌物の製法にも関する。本発明により形質転換された微生物を前記のようにして培養し、かつ培地から分泌物を単離する。
【発明の効果】
【0013】
本発明の新規微生物およびその分泌物は、胃酸の分泌を促す作用があり、耐熱性がある。抽出物は慢性胃炎などの胃酸の減少するタイプの慢性胃炎に対して、胃酸の分泌を促進し、慢性胃炎を軽化させるものであり、胃の調子を整えることで、ひいては、慢性胃炎からの癌や潰瘍を防止するものであると推測される。この菌はすべての人の胃や血液から検出され、慢性胃炎、潰瘍、癌、の患者の血液からも検出されることもままある。 胃液分泌促進に有利な特性を有するのみならず、血小板、赤血球、白血球の増加作用も見られしかも、無害であるため、多方面への応用が可能となる。
【図面の簡単な説明】
【0014】
【図1】
相同性検索説明図。
【図2】
相同性検索結果を示す図(塩基1-60)。
【図3】
相同性検索結果を示す図(塩基61-840)。
【図4】
相同性検索結果を示す図(塩基841-1480)。
【図5】
本発明の新規微生物の系統樹を示す図。
【図6】
本発明の新規微生物培養コロニーを示す図。
【図7】
同上拡大図。
【図8】
大きいコロニーのグラム染色を示す図。
【図9】
小さいコロニーのグラム染色を示す図。
【図10】
マウスの被毛に色素塗布する固体識別法を示す図。
【発明を実施するための最良の形態】
【0015】
次の例は、本発明を、例示した典型的態様において明らかにするものであるが、本発明は、その範囲内に限定されない。
【0016】
本実施例においては、まず培養条件や結果を実施例1で示し、次に分泌物の分離方法及びそれを用いた動物実験について実施例2で説明し、さらに抗腫瘍実験(実施例3)毒性試験(実施例4)臨床実験(慢性胃炎患者・実施例5)について説明する。染色実験(実施例6)について説明する。
【実施例1】
【0017】
この微生物は形態としては、点状、連鎖状ともあり、大きさは0.5~1μm×10~20μm両端に鞭毛を有し、運動性があり、8字運動をする。芽胞を有し、好気性の高いグラム陽性の桿菌及び球菌である。連鎖状ともなる。分離源は胃壁あるいは血液となる。
培養条件は以下の通りである。
培地1000ml(トリプトソーヤブイヨン)当たり
ペプトン 17g
ダイズペプトン 3g
塩化ナトリウム 5g
ブドウ糖 2.5g
リン酸水素カリウム 2.5g
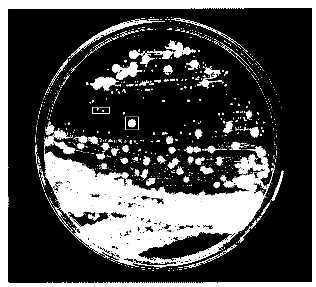
の栄養物を添加し、カセイソーダ3gを加える。pHを8.5に調整する。培地の殺菌条件は121℃ 15分 行い、培養温度は37℃ 培養期間は2から7日となる。(図6・7・8・9)
以上の条件で培養した菌の特性は偏性好気性であり、生存確認は肉眼又は顕微鏡下での観察となる。図6は、指定培地で1日培養したコロニー画像を示す。
【0018】
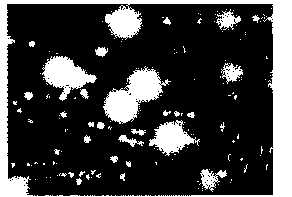
さらに、□で囲んだ右側のコロニーは表面がラフの大きいコロニーであり、長方形で囲んだ左側のコロニーは表面がスムースな小さいコロニーである。コロニーの拡大を図7に示し、グラム染色の結果を示す。前者はグラム陽性桿菌(図8)であり、後者はグラム陽性球菌(図9)となる。
保管条件は凍結乾燥など、一般に用いられている方法で可能である。
【実施例2】
【0019】
分泌物を動物に摂取した結果胃液の変化について反応をみた。
分泌物のとり方
分泌物の抽出方法については、コロニーを37℃のインキュベータに入れると2-7日後表面に白灰色あるいは明るい黄色の表面となり、これを30℃から37℃で7日間ブイヨン中で菌を培養する。
次に純粋ブチルアルコールを同量この培養濾液に加え良くかき混ぜる。
3時間放置或いは遠心分離した後、透明なブチルアルコール溶液を分離する。
この溶液に1規定の塩酸を加えpH3.0にし、良くかき混ぜ12時間放置する。次に真空乾燥させると明るい黄色の結晶と有機物質、無機物質が得られる。
ブチルアルコール溶液以外の溶液を活性炭と混入し、よくかき混ぜ1日置く。
活性炭のみをブチルアルコールに加え12時間後ブチルアルコール溶出液を真空乾燥にかける。以下同様に繰り返して結晶を得る。
【0020】
動物実験
本発明の実施例2においては、新規微生物の分泌物についてハイデンハインポーチ犬における胃酸分泌量測定試験をおこなった。
【0021】
実験方法:分泌物2.6g に媒体としては糖液5%使用した(室温保存)。
使用動物:13ヶ月齢で購入した雄性のイヌを13日間検疫及び馴化飼育し、一般状態の観察と体重測定を行い健康な動物であることを確認した後、手術日の体重が14.2~14.7kgで13ヶ月齢の動物を使用した。 環境:温度20~28℃、相対湿度30~80%、換気回数12~18回/時間、照明時間12時間(7:00~19:00)の範囲内に設定した。
飼料:ラボDストック(登録商標:日本農産工業株式会社製)
飲料水:上下水道の自動供給装置よりの自由摂取
投与方法:分泌物500mgを乳鉢に入れ乳棒を用いて糖液5%を加え溶解させた。これに糖液5%を加えて50mLとして投与液とした。
投与用量:10mg/kg
投与液量:1mL/kg 3例
測定方法:投与後2時間までの胃酸分泌量を15分ごとに測定し、胃酸分泌量の変化について検討した。
【0022】
ハイデンハインポーチ犬の作製と管理
手術日前日より18時間以上絶食させ、麻薬導入30分前にアトロピン硫酸塩(0.1mg/kg)を筋肉内投与した。前肢想橈側皮静脈よりチオペンタールナトリウムを投与し麻酔を導入後手術台の上で38℃にセットした体温コントローラーの保温パットに犬を背位に寝かせ、気管カニューレを装着し、人工呼吸及び吸入麻酔を行った。人工呼吸の1回換気量は20~25mL/kg,11~13回/minとし、吸気には、笑気1~4%の範囲で気化したものを加えて吸入麻酔を導入し、維持麻酔は0.5~2.0%で行った。腹部及びその周辺の毛を電気バリカンで除毛した後、術野全体を消毒し、腹部正中線に沿って剣状突起のやや株から臍部上部までの皮膚及び筋層を切開した後、腹腔内から胃を引き出し腹壁上に胃を露呈した。切離予定線を交差している大彎部の血管を二重結紮し切断後、切離予定線を胃腸縫合器を用いて切断縫合し、ポーチ側に胃瘻管を出した後、開腹部を縫合し、ポーチ内を暖めた生理食塩水で数回洗浄した。術後翌日より2日間は絶食とし、その間は補液(登録商標:ラクテックD 大塚製薬工業社製)を150mL/day行った。その後は通常飼育とし、脱水症を防ぐために食塩(約0.4g/day)を飼料に混ぜ与えた。
【0023】
胃液分泌測定方法
ハイデンハインポーチ犬は術後約3週間経過してから使用した。摂水下で18時間以上絶食させ、スチールパイプ製の枠内に布製の腹帯で軽く吊り下げた状態で胃液の採取を行った。分泌物投与前30分より、分泌物投与後2時間まで、15分間ごとに胃液を採取し、その胃液は、量(mL)の測定及び酸度(0.01N NaOH中和滴定の値:mEq/L)を測定し、得られた胃液量及び酸度より各測定時間の胃酸分泌量(mEq/15min)を算出した。
【0024】
結果を表1から表4に示す。
【0025】
【表1】
【0026】
【表2】
【0027】
【表3】

【0028】
【表4】

【0029】
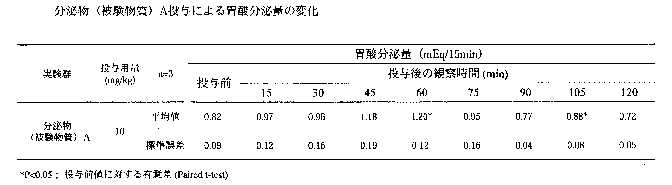
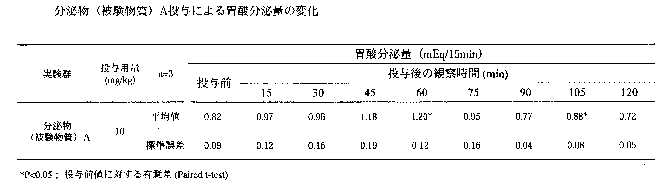
分泌物を投与して、投与後2時間までの胃酸分泌量は平均値で投与前から0.82から1.20までの数値を示し、投与後60分で最も胃酸分泌量が増加し、増加量は0.38mEq/15minであった。
【0030】
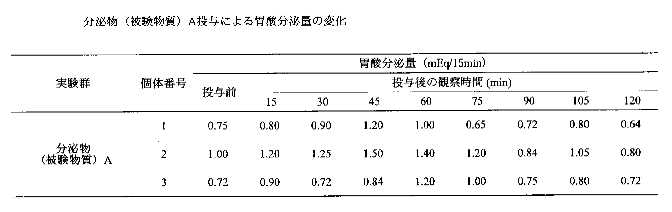
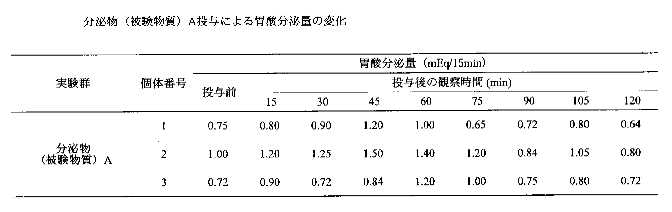
個体1・2・3の結果を表2に示す。
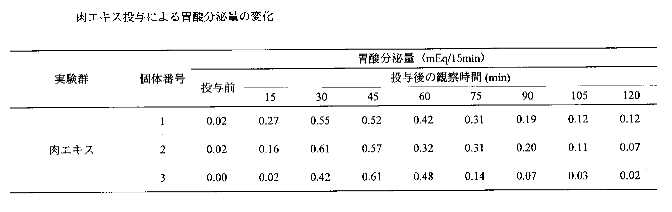
投与後60分及び105分での胃酸分泌量に投与前と比較して統計学的に有意な増加が認められた。肉エキスを投与して投与後2時間までの胃酸分泌量は平均値で投与前から0.01から0.57までの値であった。(表3・4)投与後45分後で最も胃酸分泌量が増加し、増加量は0.56mEq/15minであった。
【0031】
以上から、本件分泌物は投与後60分と105分において胃酸分泌の有意な差が認められ、統計学的に有意な差が認められなかった15、30、45及び75分でも胃酸分泌の増加傾向が認められた。
肉エキスを投与した結果と比較すると、分泌物(被験物質)は増加量でやや肉エキスより少ないが、最も増加した時間は肉エキスと近くほぼ同様の増加減少を示している。以上の結果から、分泌物(被験物質)は胃酸分泌量を増加させる効果があり、その効果は肉エキスの効果と同じであると考えられる。
【実施例3】
【0032】
本発明の実施例3において、分泌物質のXenograft modelに対する有効性の検索を目的として、腫瘍細胞株MKN-45に及ぼす影響について検討を試みた。被験物質である分泌物は4週間皮下投与した、評価項目として体重測定、腫瘍体積の測定、血液学的検査及び病理学的検査を実施した。
【0033】
実験概要
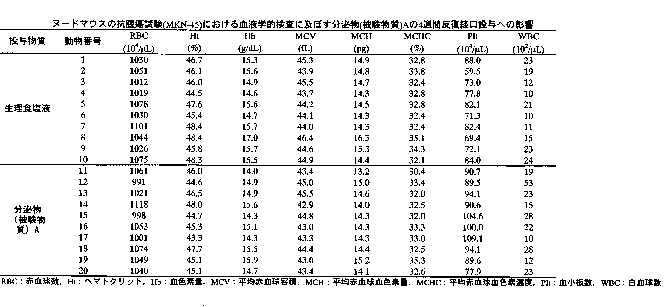
1、使用動物:4週齢で購入した雄性のBALB/C-nu系マウスの体重が15.2~20.1gの動物20匹を使用した。動物は実験期間を通じて、温度20~26℃相対湿度40~70%、喚気回数10~20回/時間、照明時間12時間の範囲内に設定したクリーン飼育室にて飼育した。
2、飼育条件:水、試料 自由摂取
3、実験群:腫瘍体積の平均が約200~300mm3に成長したところで腫瘍体積の平均が等しくなるように2群に割り当てた。
4、新規微生物の分泌物の原末100mgを高精度分析用上皿天秤を用いて精秤し、10mLの生理食塩液に溶解させた。投与液は全て用時に調製した。
5、腫瘍細胞の調製:細胞培養液は培地にペニシリン-ストレプトマイシンを100u/mL-100μmL加えて調製した。 細胞は、凍結細胞を約37℃の温湯で完全に融解し、あらかじめ37℃でインキュベートした培養液の入った遠沈管に移し取った。1000rpmで5分遠心分離後上清を捨て培養液を加えてピペッティングでよく懸濁後、培養フラスコに移し、温度37℃二酸化炭素濃度5%に設定した炭酸ガス培養器(サンヨー社製、MCO-175)で培養を開始。細胞の継体培養は、細胞密度が過剰になる前に、培養容器から培養液を除き、PBS溶液で細胞表面を洗浄後、0.25%トリプシン 1mMEDTA溶液を加えて炭酸ガス培養器に入れ、細胞を完全に剥離させた。剥離した細胞を適量の培養液で回収し、1000rpmで5分遠心分離後に、上清を除き培養液を添加し、ピペッティングした後、培養液を入れた新しい培養フラスコに細胞を播種した。継代を2~4日に1回の頻度で行い、移植には2回以上継代したものを使用した。
6、投与方法:被験物質は1日1回で4週間ディスポーザブル注射筒及び27G注射針を用いて背部皮下投与した。投与液量は週2回測定した体重に基づいて固体別に算出した。
7、腫瘍細胞:腫瘍細胞は、移植日にディスポーザブル注射筒及び27G注射針を用いて背部皮下投与した。
【0034】
以上のような実験において、1日1回 一般状態及び生死確認を行い、週2回体重測定をした。また、デジタルノギスを用いて腫瘍の長径(A)及び短径(B)を週2回測定した。測定した長径及び短径から、以下の式により腫瘍体積を求めた。
腫瘍体積(mm3)=AB2/2
【0035】
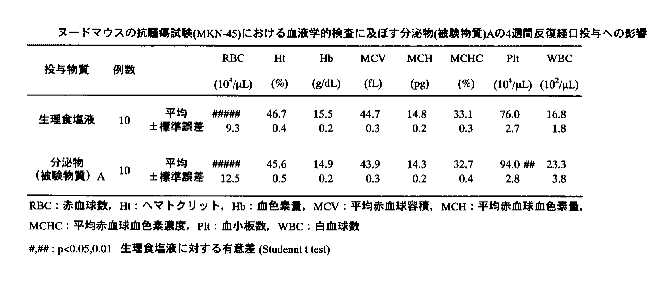
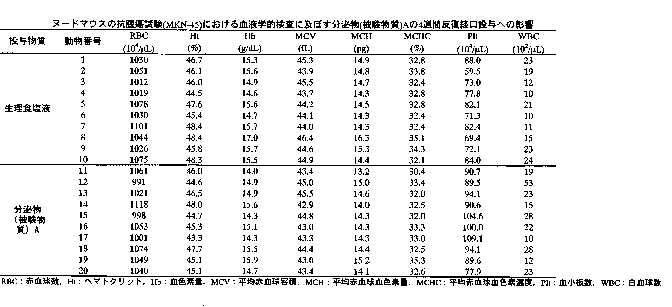
さらに血液学的検査をおこなった。全例について腹部大静脈より血液を採取後、EDTA-2K処理した血液について、以下の項目を多項目自動血球計数測定装置、(シスメックス社製 E-4000)により測定した。 結果を表5に示す。
【0036】
【表5】
【0037】
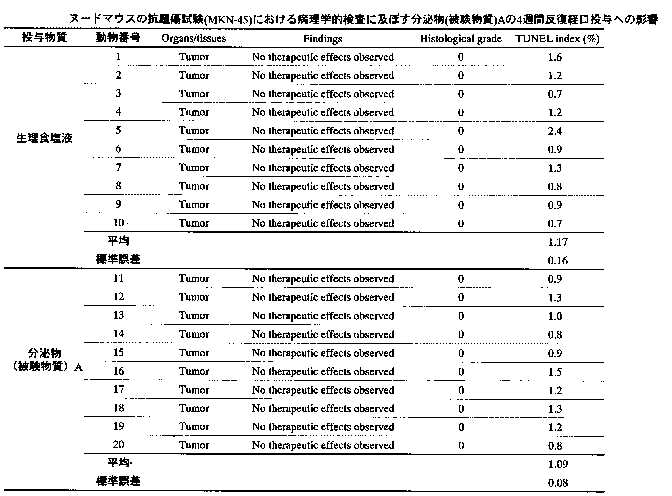
病理学的検査:採血終了後、腫瘍組織を摘出し、重量を測定した後、10%中性緩衝フォルマリン液で固定した。固定後、常法に従ってパラフィン切片を作製後、ヘマトクシリンエオジン染色を施した。その後、免疫組織化学染色(TUNEL)を行い、腫瘍細胞1000個中の陽性細胞を数え、陽性細胞/腫瘍細胞比を算出した。 20匹のマウスを使用し、背部皮下に腫瘍を移植した。移植後腫瘍体積の平均が約200~300mmに成長したところで腫瘍体積の平均が等しくなるように2群に割り当てた。被験物質を4週間連続皮下投与した。被験物質の投与日から4週間一般状態及び生死を1日1回観察し、週2回の頻度で体重測定及び腫瘍サイズ測定を行った。被験物質投与4週間後にエーテル麻酔下で腹大静脈より採血し、腫瘍組織を摘出した。
【0038】
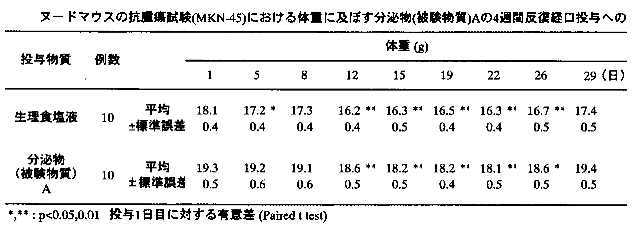
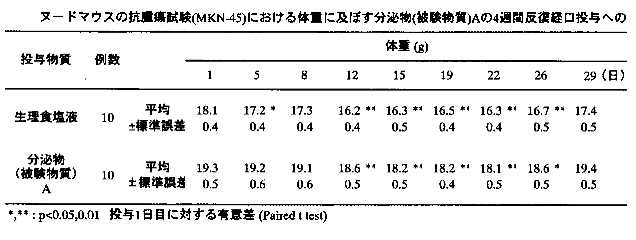
以上の試験の結果を詳細に説明する。 1)体重の推移:被験物質投与4週間の各群の体重推移を表6-7に示す。生理食塩液及び分泌物投与群の両群で、投与期間中に有意な体重の減少が観察された。体重減少のピークは、生理食塩液投与群では投与12日目、分泌物投与群では投与22日目であり、生理食塩液投与群では投与初日に比べて1.9g、分泌物投与群では投与初日に比べて1.2gの減少が認められた。
【0039】
【表6】
【0040】
【表7】
【0041】
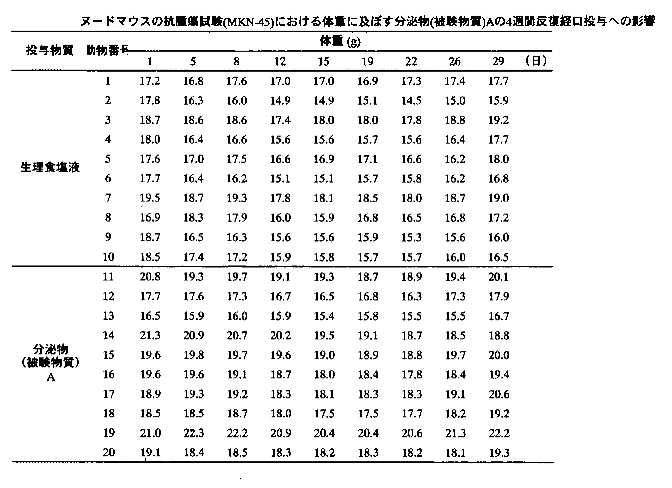
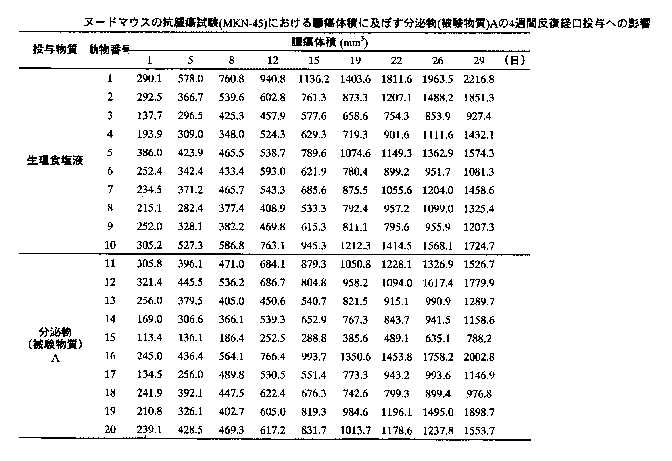
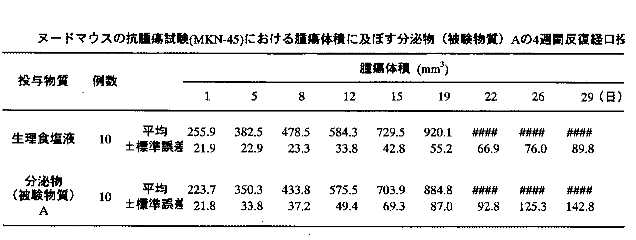
2)腫瘍体重の測定:被験物質投与4週間の各群の腫瘍体積の推移を表8-9に示す。生理食塩液投与群の腫瘍体積は、投与期間中に経日的な増加を示した。分泌物投与群の腫瘍体積についても、生理食塩液投与群と同様な増加が観察され、各測定日における両群間の腫瘍体積に、有意な変化は認められなかった。
【0042】
【表8】

【0043】
【表9】
【0044】
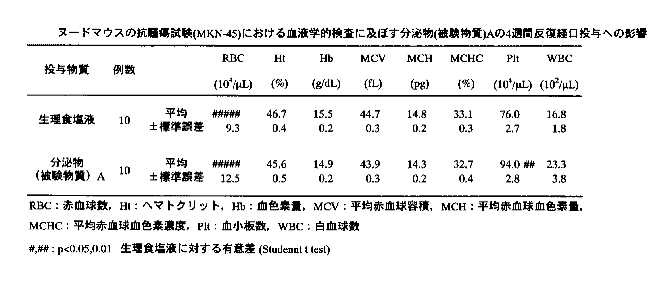
3)血液学的検査:被験物質投与4週間の各群の血液学的検査結果を表10-11に示す。検査項目のうち、血小板数について分泌物投与群で生理食塩液投与群に比べて有意な増加が認められたが、その他7項目については、生理食塩液投与群及び分泌物投与群の間に、有意な変化は認められなかった。
【0045】
【表10】
【0046】
【表11】
【0047】
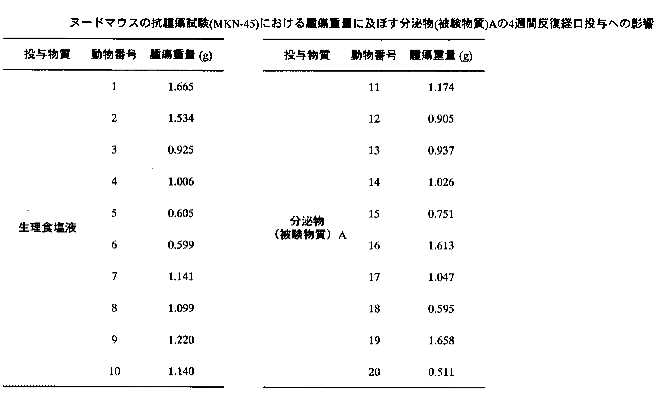
4)腫瘍重量の測定:被験物質投与4週間後に測定した各群の腫瘍重量の推移を表12-13に示す。生理食塩液及び分泌物投与群の腫瘍重量は、それぞれ1.093±0.109g及び1.022±0.016gであり、両群の重量に有意な変化は認められなかった。
【0048】
【表12】

【0049】
【表13】

【0050】
5)病理学的検査:被験物質投与4週間の各群の病理学的検査の平均値を表14-15に示す。生理食塩液及び分泌物投与群について陽性細胞/腫瘍細胞比を求めた結果、両群の数値に有意な変化は認められなかった。
【0051】
【表14】

【0052】
【表15】

【0053】
以上の結果から、投与期間中の体重について、生理食塩液及び分泌物投与群ともに、投与後2-3日後まで体重の減少が見られたが、その後は投与初日の値まで回復する傾向を示した。この体重減少は、生理食塩液投与群でも同様に認められることから、被験物質の影響ではなく腫瘍移植による影響であると考えられる。腫瘍体積については、生理食塩液及び分泌物投与群で、投与期間中に同様の腫瘍体積の増加が観察され、分泌物投与による、腫瘍体積の減少は認められなかった。血液学的検査においては、分泌物投与群の血小板数で、有意な増加が認められた。これらの結果から本発明の分泌物には、腫瘍細胞を増大させる作用はないことが明白となった。従って胃がん等の消化器系の腫瘍を持つ患者にも胃液亢進のために安心して投与できることが明白となった。
【0054】
それとともに、投与後2-3日後まで体重の減少が見られたが、有意な変化は認められなかった。 腫瘍体重の測定:被験物質投与4週間の各群の腫瘍体積の推移を表8-9に示す。生理食塩液投与群の腫瘍体積は、投与期間中に経日的な増加を示した。分泌物投与群の腫瘍体積についても、生理食塩液投与群と同様な増加が観察され、各測定日における両群間の腫瘍体積に、有意な変化は認められなかった。
【実施例4】
【0055】
本発明の実施例4(新規微生物分泌物のマウスにおける単回皮皮下投与毒性試験)を、図10を用いて説明する。この試験は新規微生物分泌物をマウスに単回皮下投与した場合の致死量及び毒性学的様相について検討したものである。
【0056】
使用した本発明新規微生物の分泌物 1 性状:黄褐色、針状結晶 2 溶解性:蒸留水及び5%ブドウ糖液に可溶 3 安定性:加水分解性、空気酸化性、光分解性および熱分解性がないため安定している。但しpH8以上では時に白濁化する。 4 保存条件:室温 密封(乾燥剤封入) 5 保管場所:室温保管庫
【0057】
使用したマウス
1 種、系統、性:マウス{Slc:ICR}、SPF動物、雄
2 週齢:4週齢のものを5週齢に群分け、6週齢から実験に使用開始
3 群分け時の体重:29.4~33.9g
4 飼育環境条件:温度22.2~22.7℃、湿度48.6~64.2%、RH・明暗周期12時間、喚起回数10回/時間、試料飲料水自由摂取
5 固体識別法:各投与群の5匹の動物には、ピクリン酸飽和水溶液を用いて、図10に示したマウスの被毛に色素塗布をおこない固体識別をおこなった。
6 投与液の調整方法:分泌物と溶媒(蒸留水)を秤量したのち、乳鉢を用いて分泌物と溶媒を徐々に混和粉砕・懸濁し所定量とした。
7 投与量:表5に示した投与用量及び群構成とした。投与用量としては、医薬品非臨床試験ガイドラインの上限である2,000mg/kgを高用量として、その半量の1,000mg/kg、及びコントロール(対照群)を設定した。
8 投与方法:皮下投与とし、いずれの投与群についても20mL/kgとし、投与直前の体重値から算出した各投与液を26Gの注射針を装着した注射筒でマウスの頚背部皮下に投与した。投与期間は1日目(Day1)の1回のみとし、午前中に投与をおこなった。
9 観察期間:投与日を1日とし、15日目までとした。観察時間としては、1日目のみ投与直後、投与1,2,4時間後および投与約6時間後に生死確認及び一般状態の観察を実施した。投与日以外は、午前中に生死確認及び一般状態の観察を行い、午後に生死確認のみを実施した。一般状態の観察は、外観(被毛、眼、耳、鼻、肛門、外陰部等)、行動、姿勢、呼吸、筋緊張および糞尿等について異常の有無及び程度について肉眼的に行い、体重測定を行った。
10 病理解剖学的検査:途中死亡例が無かったことから、各投与群の生存例については、15日目にペントバルピタールナトリウム麻酔下(100mg/kg腹腔内投与)で開腹し、腹大動静脈血管を切断し放血安楽死させたのちに、すみやかに病理学的手技に従って解剖し、体表、開孔部、頭蓋、胸腔、腹腔の器官・組織を観察した。
【0058】
このような実験の結果としては、以下のことが判明した。
1)死亡動物の発生の有無 いずれの投与群においても途中死亡及び瀕死状態は認められなかった。
2)一般状態 いずれの投与群においても一般状態の変化は認められなかった。
3)体重推移 1,000mg/kg 2,000mg/kg投与群では、投与翌日の体重が用量に依存して減少(軽度)を示し、2,000mg/kg投与群では、対照と比較して有意な減少であった。なお、1,000および2,000mg/kg投与群の3日目から15日目における体重推移は、対照群と同等の増加推移であった。
4)病理解剖学的検査 1,000mg/kg投与群の2/5例及び2,000mg/kg投与群の5/5例において、投与部位(頚背部の皮下組織)に分泌物と思われる緑褐色の沈着(軽度)が用量に依存してみられた。また、1,000mg/kg投与群の1/5例では精巣(左側)の小型(軽度)が認められた以外の異常所見は観察されなかった。
【0059】
以上のことから、分泌物をマウスに単回皮下投与し、15日間の観察をおこなった場合の致死用量及び毒性学的様相についての検討では、2日目の体重が用量に依存して減少(軽度)したが、3日目以降は、対照群と同様の体重増加推移が観察されたことから、分泌物投与の体重推移に対する影響は軽度なものと考えられた。病理解剖学的検査では、投与部位に分泌物の残存と思われる沈着(軽度)がみられたことから、分泌物の皮下吸収は悪いものと示唆されたが、投与部位では炎症性反応等の変化が観察がされなかったことから刺激性は低いと推移された。さらに、病理解剖学的検査では、その他の観察部位においても異常所見がみられなかったことから、分泌物に起因した明らかな毒性変化は認められなかった。
【0060】
以上のことから、分泌物に起因した明らかな毒性変化はなく、また、瀕死・死亡動物が見られないことから、最小致死用量は2,000mg/kg以上と推察された。 従って、本微生物の分泌物質は無毒といえ治療に用いることが可能である。
【実施例5】
【0061】
本発明の実施例5を説明する。
[症例1]
本症例はピロリ菌治療を行っている患者Aに対して、ピロリ菌除去剤とともに、本発明の新規微生物を皮下注射した結果を説明する。
作成方法:実施例2と同様にして抽出した分泌物
投与方法:生理食塩水に0.2g混合し、患者Aに皮下注射した(1日2回)7日間投与した。
結果:患者Aは8日後胃の改善が見られた。胃壁から任意に採取した切片からも、顕微鏡で見たところ新規微生物が確認できた。胃が軽く、もたれる感じがなく、翌朝の胸焼けも発生しなくなった。胃の調子が非常に改善した。
【実施例6】
【0062】
本発明の実施例6を説明する。 上記実施例5で採取された切片をギムザ染色したところ本件新規微生物が8の字運動をしていることが顕微鏡で確認できた。
【産業上の利用可能性】
【0063】
本発明によれば、慢性胃炎の患者に対して、胃液の分泌を促進することができ、しかも無害であることが実験により確認されたため、産業上の利用可能性を有する。
利用分野
【技術分野】
【0001】
本発明は、バチルス・プミルス(Bacillus pumilus)種に属する新規微生物に関するもので、慢性胃炎による胃酸の減少に対して胃液の分泌を促す作用を有する新規微生物、その分泌物組成物及びそれらを使用したプラスミドに関する。
従来の技術
【背景技術】
【0002】
胃潰瘍、十二指腸潰瘍等の消化性潰瘍は、消化液などの内臓壁への攻撃因子抑制剤(胃酸分泌抑制剤、胃酸中和剤、胃酸中和剤等)や防御因子増強剤(粘膜保護剤等)が使用されていた。しかし慢性胃炎、とりわけ無酸性胃炎の患者には胃酸の分泌促進が効果的であると思われるが、生体に無害である胃液促進剤については開発されていないのが現状である。
【0003】
胃潰瘍の原因の1つである細菌ヘリコバクター・ピロリの感染の場合には慢性胃炎を生ぜしめ揚句の果てに潰瘍・癌を誘発させる。すなわち、胃の状態を悪化させる菌であるが、同じ微生物でありながら、胃の状態を改善する微生物は未だ発見されていないのが実情である。
効果
【発明の効果】
【0013】
本発明の新規微生物およびその分泌物は、胃酸の分泌を促す作用があり、耐熱性がある。抽出物は慢性胃炎などの胃酸の減少するタイプの慢性胃炎に対して、胃酸の分泌を促進し、慢性胃炎を軽化させるものであり、胃の調子を整えることで、ひいては、慢性胃炎からの癌や潰瘍を防止するものであると推測される。この菌はすべての人の胃や血液から検出され、慢性胃炎、潰瘍、癌、の患者の血液からも検出されることもままある。
胃液分泌促進に有利な特性を有するのみならず、血小板、赤血球、白血球の増加作用も見られしかも、無害であるため、多方面への応用が可能となる。
課題
【発明が解決しようとする課題】
【0004】
従って、ピロリ菌に対抗できるような胃の調子を改善する微生物の発見が望まれていた。また発見された新規の微生物及びその分泌物を利用した治療剤の製造が課題であった。
【0005】
本発明の新規微生物は、発明者の実験によれば、全くピロリ菌とは逆の環境、すなわち慢性胃炎特に胃酸の減少するタイプの慢性胃炎に対して、胃液の分泌を促進し、慢性胃炎を軽化させるものであり、ひいては、慢性胃炎からの癌や潰瘍を防止するものであると推測される。従って、すべての人の胃や血液から検出され、慢性胃炎、潰瘍、癌、の患者の血液からも検出されることもままある。
胃液分泌促進に有利な特性を有するのみならず、血小板、赤血球、白血球の増加作用も見られるため、多方面の応用が可能となる。
手段
【課題を解決するための手段】
【0006】
バチルス・プミルス種に属する新規微生物(国際寄託番号NITE BP-295)に動物実験の結果胃液分泌促進効果が認められ、しかもLD50 2g以上のため、無害であることも判明したものである。
【0007】
この微生物は形態としては、点状、連鎖状ともあり、大きさは0.5~1μm×10~20μm両端に鞭毛を有し、運動性があり、8字運動をする。芽胞を有し、好気性の高いグラム陽性の桿菌及び球菌である。連鎖状ともなる。分離源はヒトの胃壁あるいは血液となる。あるいは慢性胃炎を生ぜしめるウイルスを受精卵に植え付け対抗して出現する菌を採取しても良い。
【0008】
培養条件は以下の通りである。
培地1000ml(トリプトソーヤブイヨン)当たり
ペプトン 17g
ダイズペプトン 3g
塩化ナトリウム 5g
ブドウ糖 2.5g
リン酸水素カリウム 2.5g
の栄養物を添加し、カセイソーダ3gを加える。pHを8.5に調整する。培地の殺菌条件は121℃ 15分 行い、培養温度は37℃ 培養期間は2から7日となる。
以上の条件で培養した菌の特性は偏性好気性であり、生存確認は肉眼又は顕微鏡下での観察となる。
保管条件は凍結乾燥など、一般に用いられている方法で可能である。
【0009】
このようにして採取した新規微生物は下記の特徴を有する。なお、これらは顕微鏡観察等によるものである。
1 遺伝子配病原細菌を貪食するときにはその抗菌性が強まる。
2 病原細菌により形を変える。
3 代謝産物である分泌物質は、褐色をしている。
4 新規微生物は赤血球を侵さない。(赤血球でいうと普通抗がん剤を用いても赤血球の数が減少せずHb12-16のままであり赤血球が減少していない、C型肝炎なら6ぐらいとなる)。
5 新規微生物は死んだ組織体を清浄化する。
6 新規微生物は放射線、紫外線、微音波に弱い。
7 新規微生物は耐熱性が強く、数時間100℃に耐えることができ、破壊されない。オートクレーブをかけても生きている。
8 赤血球、血小板、白血球の増加を促し、貧血の改善が見られる。(白血球が6000あった患者において抗がん剤の投与後でも500以上の白血球数値認められることからこの菌による増加作用が認められる。血小板は200,000であった患者において、抗がん剤の投与後でも3,000程度にしか落ちないことから、この菌による増加作用が認められる。)
【0010】
この配列は一部配列決定を行い、配列番号1に示す、遺伝子配列を有することが判明している。さらに図2―図4に示すように99%の相同性でバチルス・プミルス種であると判断した。系統樹は図5のようになる。配列の一部が特定できていることで、プラスミド発現ベクターなどへの応用等が可能となり、大量培養やスクリーニング、製薬などにおいて多大の効果が期待できる。
【0011】
分泌物の抽出方法については以下の通りである。まず33~37℃で7日間ブイヨン中で菌を培養する。次に純粋ブチルアルコールを同量この培養濾液に加え良くかき混ぜる。3時間放置或いは遠心分離した後、透明なブチルアルコール溶液を分離する。この溶液に1規定の塩酸を加えpH3.0にし、良くかき混ぜ12時間放置する。次に真空乾燥させると明るい黄色の結晶と有機物質、無機物質が得られる。
ブチルアルコール溶液以外の溶液を活性炭と混入し、よくかき混ぜ1日置く。
活性炭のみをブチルアルコールに加え12時間後ブチルアルコール溶出液を真空乾燥にかける。以下同様に繰り返して結晶を得る。
【0012】
本発明は前記分泌物のアミノ酸配列をコードするようなDNA-配列を有する発現ベクターを含有する、形質転換された微生物を用いる本発明の分泌物の製法にも関する。本発明により形質転換された微生物を前記のようにして培養し、かつ培地から分泌物を単離する。
実施例
【実施例1】
【0017】
この微生物は形態としては、点状、連鎖状ともあり、大きさは0.5~1μm×10~20μm両端に鞭毛を有し、運動性があり、8字運動をする。芽胞を有し、好気性の高いグラム陽性の桿菌及び球菌である。連鎖状ともなる。分離源は胃壁あるいは血液となる。
培養条件は以下の通りである。
培地1000ml(トリプトソーヤブイヨン)当たり
ペプトン 17g
ダイズペプトン 3g
塩化ナトリウム 5g
ブドウ糖 2.5g
リン酸水素カリウム 2.5g
の栄養物を添加し、カセイソーダ3gを加える。pHを8.5に調整する。培地の殺菌条件は121℃ 15分 行い、培養温度は37℃ 培養期間は2から7日となる。(図6・7・8・9)
以上の条件で培養した菌の特性は偏性好気性であり、生存確認は肉眼又は顕微鏡下での観察となる。図6は、指定培地で1日培養したコロニー画像を示す。
【0018】
さらに、□で囲んだ右側のコロニーは表面がラフの大きいコロニーであり、長方形で囲んだ左側のコロニーは表面がスムースな小さいコロニーである。コロニーの拡大を図7に示し、グラム染色の結果を示す。前者はグラム陽性桿菌(図8)であり、後者はグラム陽性球菌(図9)となる。
保管条件は凍結乾燥など、一般に用いられている方法で可能である。
【実施例2】
【0019】
分泌物を動物に摂取した結果胃液の変化について反応をみた。
分泌物のとり方
分泌物の抽出方法については、コロニーを37℃のインキュベータに入れると2-7日後表面に白灰色あるいは明るい黄色の表面となり、これを30℃から37℃で7日間ブイヨン中で菌を培養する。
次に純粋ブチルアルコールを同量この培養濾液に加え良くかき混ぜる。
3時間放置或いは遠心分離した後、透明なブチルアルコール溶液を分離する。
この溶液に1規定の塩酸を加えpH3.0にし、良くかき混ぜ12時間放置する。次に真空乾燥させると明るい黄色の結晶と有機物質、無機物質が得られる。
ブチルアルコール溶液以外の溶液を活性炭と混入し、よくかき混ぜ1日置く。
活性炭のみをブチルアルコールに加え12時間後ブチルアルコール溶出液を真空乾燥にかける。以下同様に繰り返して結晶を得る。
【0020】
動物実験
本発明の実施例2においては、新規微生物の分泌物についてハイデンハインポーチ犬における胃酸分泌量測定試験をおこなった。
【0021】
実験方法:分泌物2.6g に媒体としては糖液5%使用した(室温保存)。
使用動物:13ヶ月齢で購入した雄性のイヌを13日間検疫及び馴化飼育し、一般状態の観察と体重測定を行い健康な動物であることを確認した後、手術日の体重が14.2~14.7kgで13ヶ月齢の動物を使用した。
環境:温度20~28℃、相対湿度30~80%、換気回数12~18回/時間、照明時間12時間(7:00~19:00)の範囲内に設定した。
飼料:ラボDストック(登録商標:日本農産工業株式会社製)
飲料水:上下水道の自動供給装置よりの自由摂取
投与方法:分泌物500mgを乳鉢に入れ乳棒を用いて糖液5%を加え溶解させた。これに糖液5%を加えて50mLとして投与液とした。
投与用量:10mg/kg
投与液量:1mL/kg 3例
測定方法:投与後2時間までの胃酸分泌量を15分ごとに測定し、胃酸分泌量の変化について検討した。
【0022】
ハイデンハインポーチ犬の作製と管理
手術日前日より18時間以上絶食させ、麻薬導入30分前にアトロピン硫酸塩(0.1mg/kg)を筋肉内投与した。前肢想橈側皮静脈よりチオペンタールナトリウムを投与し麻酔を導入後手術台の上で38℃にセットした体温コントローラーの保温パットに犬を背位に寝かせ、気管カニューレを装着し、人工呼吸及び吸入麻酔を行った。人工呼吸の1回換気量は20~25mL/kg,11~13回/minとし、吸気には、笑気1~4%の範囲で気化したものを加えて吸入麻酔を導入し、維持麻酔は0.5~2.0%で行った。腹部及びその周辺の毛を電気バリカンで除毛した後、術野全体を消毒し、腹部正中線に沿って剣状突起のやや株から臍部上部までの皮膚及び筋層を切開した後、腹腔内から胃を引き出し腹壁上に胃を露呈した。切離予定線を交差している大彎部の血管を二重結紮し切断後、切離予定線を胃腸縫合器を用いて切断縫合し、ポーチ側に胃瘻管を出した後、開腹部を縫合し、ポーチ内を暖めた生理食塩水で数回洗浄した。術後翌日より2日間は絶食とし、その間は補液(登録商標:ラクテックD 大塚製薬工業社製)を150mL/day行った。その後は通常飼育とし、脱水症を防ぐために食塩(約0.4g/day)を飼料に混ぜ与えた。
【0023】
胃液分泌測定方法
ハイデンハインポーチ犬は術後約3週間経過してから使用した。摂水下で18時間以上絶食させ、スチールパイプ製の枠内に布製の腹帯で軽く吊り下げた状態で胃液の採取を行った。分泌物投与前30分より、分泌物投与後2時間まで、15分間ごとに胃液を採取し、その胃液は、量(mL)の測定及び酸度(0.01N NaOH中和滴定の値:mEq/L)を測定し、得られた胃液量及び酸度より各測定時間の胃酸分泌量(mEq/15min)を算出した。
【0024】
結果を表1から表4に示す。
【0025】
【表1】
【0026】
【表2】
【0027】
【表3】

【0028】
【表4】
【0029】
分泌物を投与して、投与後2時間までの胃酸分泌量は平均値で投与前から0.82から1.20までの数値を示し、投与後60分で最も胃酸分泌量が増加し、増加量は0.38mEq/15minであった。
【0030】
個体1・2・3の結果を表2に示す。
投与後60分及び105分での胃酸分泌量に投与前と比較して統計学的に有意な増加が認められた。肉エキスを投与して投与後2時間までの胃酸分泌量は平均値で投与前から0.01から0.57までの値であった。(表3・4)投与後45分後で最も胃酸分泌量が増加し、増加量は0.56mEq/15minであった。
【0031】
以上から、本件分泌物は投与後60分と105分において胃酸分泌の有意な差が認められ、統計学的に有意な差が認められなかった15、30、45及び75分でも胃酸分泌の増加傾向が認められた。
肉エキスを投与した結果と比較すると、分泌物(被験物質)は増加量でやや肉エキスより少ないが、最も増加した時間は肉エキスと近くほぼ同様の増加減少を示している。以上の結果から、分泌物(被験物質)は胃酸分泌量を増加させる効果があり、その効果は肉エキスの効果と同じであると考えられる。
【実施例3】
【0032】
本発明の実施例3において、分泌物質のXenograft modelに対する有効性の検索を目的として、腫瘍細胞株MKN-45に及ぼす影響について検討を試みた。被験物質である分泌物は4週間皮下投与した、評価項目として体重測定、腫瘍体積の測定、血液学的検査及び病理学的検査を実施した。
【0033】
実験概要
1、使用動物:4週齢で購入した雄性のBALB/C-nu系マウスの体重が15.2~20.1gの動物20匹を使用した。動物は実験期間を通じて、温度20~26℃相対湿度40~70%、喚気回数10~20回/時間、照明時間12時間の範囲内に設定したクリーン飼育室にて飼育した。
2、飼育条件:水、試料 自由摂取
3、実験群:腫瘍体積の平均が約200~300mm3に成長したところで腫瘍体積の平均が等しくなるように2群に割り当てた。
4、新規微生物の分泌物の原末100mgを高精度分析用上皿天秤を用いて精秤し、10mLの生理食塩液に溶解させた。投与液は全て用時に調製した。
5、腫瘍細胞の調製:細胞培養液は培地にペニシリン-ストレプトマイシンを100u/mL-100μmL加えて調製した。
細胞は、凍結細胞を約37℃の温湯で完全に融解し、あらかじめ37℃でインキュベートした培養液の入った遠沈管に移し取った。1000rpmで5分遠心分離後上清を捨て培養液を加えてピペッティングでよく懸濁後、培養フラスコに移し、温度37℃二酸化炭素濃度5%に設定した炭酸ガス培養器(サンヨー社製、MCO-175)で培養を開始。細胞の継体培養は、細胞密度が過剰になる前に、培養容器から培養液を除き、PBS溶液で細胞表面を洗浄後、0.25%トリプシン 1mMEDTA溶液を加えて炭酸ガス培養器に入れ、細胞を完全に剥離させた。剥離した細胞を適量の培養液で回収し、1000rpmで5分遠心分離後に、上清を除き培養液を添加し、ピペッティングした後、培養液を入れた新しい培養フラスコに細胞を播種した。継代を2~4日に1回の頻度で行い、移植には2回以上継代したものを使用した。
6、投与方法:被験物質は1日1回で4週間ディスポーザブル注射筒及び27G注射針を用いて背部皮下投与した。投与液量は週2回測定した体重に基づいて固体別に算出した。
7、腫瘍細胞:腫瘍細胞は、移植日にディスポーザブル注射筒及び27G注射針を用いて背部皮下投与した。
【0034】
以上のような実験において、1日1回 一般状態及び生死確認を行い、週2回体重測定をした。また、デジタルノギスを用いて腫瘍の長径(A)及び短径(B)を週2回測定した。測定した長径及び短径から、以下の式により腫瘍体積を求めた。
腫瘍体積(mm3)=AB2/2
【0035】
さらに血液学的検査をおこなった。全例について腹部大静脈より血液を採取後、EDTA-2K処理した血液について、以下の項目を多項目自動血球計数測定装置、(シスメックス社製 E-4000)により測定した。
結果を表5に示す。
【0036】
【表5】


【0037】
病理学的検査:採血終了後、腫瘍組織を摘出し、重量を測定した後、10%中性緩衝フォルマリン液で固定した。固定後、常法に従ってパラフィン切片を作製後、ヘマトクシリンエオジン染色を施した。その後、免疫組織化学染色(TUNEL)を行い、腫瘍細胞1000個中の陽性細胞を数え、陽性細胞/腫瘍細胞比を算出した。
20匹のマウスを使用し、背部皮下に腫瘍を移植した。移植後腫瘍体積の平均が約200~300mmに成長したところで腫瘍体積の平均が等しくなるように2群に割り当てた。被験物質を4週間連続皮下投与した。被験物質の投与日から4週間一般状態及び生死を1日1回観察し、週2回の頻度で体重測定及び腫瘍サイズ測定を行った。被験物質投与4週間後にエーテル麻酔下で腹大静脈より採血し、腫瘍組織を摘出した。
【0038】
以上の試験の結果を詳細に説明する。
1)体重の推移:被験物質投与4週間の各群の体重推移を表6-7に示す。生理食塩液及び分泌物投与群の両群で、投与期間中に有意な体重の減少が観察された。体重減少のピークは、生理食塩液投与群では投与12日目、分泌物投与群では投与22日目であり、生理食塩液投与群では投与初日に比べて1.9g、分泌物投与群では投与初日に比べて1.2gの減少が認められた。
【0039】
【表6】
【0040】
【表7】
【0041】
2)腫瘍体重の測定:被験物質投与4週間の各群の腫瘍体積の推移を表8-9に示す。生理食塩液投与群の腫瘍体積は、投与期間中に経日的な増加を示した。分泌物投与群の腫瘍体積についても、生理食塩液投与群と同様な増加が観察され、各測定日における両群間の腫瘍体積に、有意な変化は認められなかった。
【0042】
【表8】
【0043】
【表9】
【0044】
3)血液学的検査:被験物質投与4週間の各群の血液学的検査結果を表10-11に示す。検査項目のうち、血小板数について分泌物投与群で生理食塩液投与群に比べて有意な増加が認められたが、その他7項目については、生理食塩液投与群及び分泌物投与群の間に、有意な変化は認められなかった。
【0045】
【表10】
【0046】
【表11】
【0047】
4)腫瘍重量の測定:被験物質投与4週間後に測定した各群の腫瘍重量の推移を表12-13に示す。生理食塩液及び分泌物投与群の腫瘍重量は、それぞれ1.093±0.109g及び1.022±0.016gであり、両群の重量に有意な変化は認められなかった。
【0048】
【表12】

【0049】
【表13】
【0050】
5)病理学的検査:被験物質投与4週間の各群の病理学的検査の平均値を表14-15に示す。生理食塩液及び分泌物投与群について陽性細胞/腫瘍細胞比を求めた結果、両群の数値に有意な変化は認められなかった。
【0051】
【表14】

【0052】
【表15】
【0053】
以上の結果から、投与期間中の体重について、生理食塩液及び分泌物投与群ともに、投与後2-3日後まで体重の減少が見られたが、その後は投与初日の値まで回復する傾向を示した。この体重減少は、生理食塩液投与群でも同様に認められることから、被験物質の影響ではなく腫瘍移植による影響であると考えられる。腫瘍体積については、生理食塩液及び分泌物投与群で、投与期間中に同様の腫瘍体積の増加が観察され、分泌物投与による、腫瘍体積の減少は認められなかった。血液学的検査においては、分泌物投与群の血小板数で、有意な増加が認められた。これらの結果から本発明の分泌物には、腫瘍細胞を増大させる作用はないことが明白となった。従って胃がん等の消化器系の腫瘍を持つ患者にも胃液亢進のために安心して投与できることが明白となった。
【0054】
それとともに、投与後2-3日後まで体重の減少が見られたが、有意な変化は認められなかった。
腫瘍体重の測定:被験物質投与4週間の各群の腫瘍体積の推移を表8-9に示す。生理食塩液投与群の腫瘍体積は、投与期間中に経日的な増加を示した。分泌物投与群の腫瘍体積についても、生理食塩液投与群と同様な増加が観察され、各測定日における両群間の腫瘍体積に、有意な変化は認められなかった。
【実施例4】
【0055】
本発明の実施例4(新規微生物分泌物のマウスにおける単回皮皮下投与毒性試験)を、図10を用いて説明する。この試験は新規微生物分泌物をマウスに単回皮下投与した場合の致死量及び毒性学的様相について検討したものである。
【0056】
使用した本発明新規微生物の分泌物
1 性状:黄褐色、針状結晶
2 溶解性:蒸留水及び5%ブドウ糖液に可溶
3 安定性:加水分解性、空気酸化性、光分解性および熱分解性がないため安定している。但しpH8以上では時に白濁化する。
4 保存条件:室温 密封(乾燥剤封入)
5 保管場所:室温保管庫
【0057】
使用したマウス
1 種、系統、性:マウス{Slc:ICR}、SPF動物、雄
2 週齢:4週齢のものを5週齢に群分け、6週齢から実験に使用開始
3 群分け時の体重:29.4~33.9g
4 飼育環境条件:温度22.2~22.7℃、湿度48.6~64.2%、RH・明暗周期12時間、喚起回数10回/時間、試料飲料水自由摂取
5 固体識別法:各投与群の5匹の動物には、ピクリン酸飽和水溶液を用いて、図10に示したマウスの被毛に色素塗布をおこない固体識別をおこなった。
6 投与液の調整方法:分泌物と溶媒(蒸留水)を秤量したのち、乳鉢を用いて分泌物と溶媒を徐々に混和粉砕・懸濁し所定量とした。
7 投与量:表5に示した投与用量及び群構成とした。投与用量としては、医薬品非臨床試験ガイドラインの上限である2,000mg/kgを高用量として、その半量の1,000mg/kg、及びコントロール(対照群)を設定した。
8 投与方法:皮下投与とし、いずれの投与群についても20mL/kgとし、投与直前の体重値から算出した各投与液を26Gの注射針を装着した注射筒でマウスの頚背部皮下に投与した。投与期間は1日目(Day1)の1回のみとし、午前中に投与をおこなった。
9 観察期間:投与日を1日とし、15日目までとした。観察時間としては、1日目のみ投与直後、投与1,2,4時間後および投与約6時間後に生死確認及び一般状態の観察を実施した。投与日以外は、午前中に生死確認及び一般状態の観察を行い、午後に生死確認のみを実施した。一般状態の観察は、外観(被毛、眼、耳、鼻、肛門、外陰部等)、行動、姿勢、呼吸、筋緊張および糞尿等について異常の有無及び程度について肉眼的に行い、体重測定を行った。
10 病理解剖学的検査:途中死亡例が無かったことから、各投与群の生存例については、15日目にペントバルピタールナトリウム麻酔下(100mg/kg腹腔内投与)で開腹し、腹大動静脈血管を切断し放血安楽死させたのちに、すみやかに病理学的手技に従って解剖し、体表、開孔部、頭蓋、胸腔、腹腔の器官・組織を観察した。
【0058】
このような実験の結果としては、以下のことが判明した。
1)死亡動物の発生の有無
いずれの投与群においても途中死亡及び瀕死状態は認められなかった。
2)一般状態
いずれの投与群においても一般状態の変化は認められなかった。
3)体重推移
1,000mg/kg 2,000mg/kg投与群では、投与翌日の体重が用量に依存して減少(軽度)を示し、2,000mg/kg投与群では、対照と比較して有意な減少であった。なお、1,000および2,000mg/kg投与群の3日目から15日目における体重推移は、対照群と同等の増加推移であった。
4)病理解剖学的検査
1,000mg/kg投与群の2/5例及び2,000mg/kg投与群の5/5例において、投与部位(頚背部の皮下組織)に分泌物と思われる緑褐色の沈着(軽度)が用量に依存してみられた。また、1,000mg/kg投与群の1/5例では精巣(左側)の小型(軽度)が認められた以外の異常所見は観察されなかった。
【0059】
以上のことから、分泌物をマウスに単回皮下投与し、15日間の観察をおこなった場合の致死用量及び毒性学的様相についての検討では、2日目の体重が用量に依存して減少(軽度)したが、3日目以降は、対照群と同様の体重増加推移が観察されたことから、分泌物投与の体重推移に対する影響は軽度なものと考えられた。病理解剖学的検査では、投与部位に分泌物の残存と思われる沈着(軽度)がみられたことから、分泌物の皮下吸収は悪いものと示唆されたが、投与部位では炎症性反応等の変化が観察がされなかったことから刺激性は低いと推移された。さらに、病理解剖学的検査では、その他の観察部位においても異常所見がみられなかったことから、分泌物に起因した明らかな毒性変化は認められなかった。
【0060】
以上のことから、分泌物に起因した明らかな毒性変化はなく、また、瀕死・死亡動物が見られないことから、最小致死用量は2,000mg/kg以上と推察された。
従って、本微生物の分泌物質は無毒といえ治療に用いることが可能である。
【実施例5】
【0061】
本発明の実施例5を説明する。
[症例1]
本症例はピロリ菌治療を行っている患者Aに対して、ピロリ菌除去剤とともに、本発明の新規微生物を皮下注射した結果を説明する。
作成方法:実施例2と同様にして抽出した分泌物
投与方法:生理食塩水に0.2g混合し、患者Aに皮下注射した(1日2回)7日間投与した。
結果:患者Aは8日後胃の改善が見られた。胃壁から任意に採取した切片からも、顕微鏡で見たところ新規微生物が確認できた。胃が軽く、もたれる感じがなく、翌朝の胸焼けも発生しなくなった。胃の調子が非常に改善した。
【実施例6】
【0062】
本発明の実施例6を説明する。
上記実施例5で採取された切片をギムザ染色したところ本件新規微生物が8の字運動をしていることが顕微鏡で確認できた。
図の説明
【図面の簡単な説明】
【0014】
【図1】相同性検索説明図。

【図2】相同性検索結果を示す図(塩基1-60)。

【図3】相同性検索結果を示す図(塩基61-840)。

【図4】相同性検索結果を示す図(塩基841-1480)。

【図5】本発明の新規微生物の系統樹を示す図。

【図6】本発明の新規微生物培養コロニーを示す図。
【図7】同上拡大図。
【図8】大きいコロニーのグラム染色を示す図。

【図9】小さいコロニーのグラム染色を示す図。

【図10】マウスの被毛に色素塗布する固体識別法を示す図。