【アルカリ性とは…】 アルカリの共通な性質をアルカリ性という。 アルカリはアラビア語の「灰(はい)」という意味がある。 アルカリ性のことを塩基性(えんきせい)ということもある。 〈 アルカリの性質 〉 ① なめるとしぶみがある。 ② 赤色リトマス紙を青色にする。 ③ BTB溶液を青色にする。 ④ フェノールフタレイン溶液をうすい赤色にする。 ④ 指先につけると、ぬるぬるする。 ⑤ 2本の電極(でんきょく)を入れ、電圧を加えると電流 が流れる。 ⑥ 酸と反応して、酸の性質をうちけす。 アルカリ性の水溶液には、必ずOH-(水酸化物イオン)が ふくまれている。 |
アルカリ性とは…
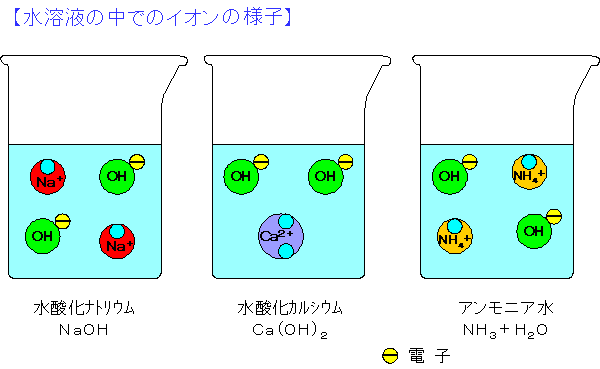
【アルカリ(塩基)の種類】 アルカリには主に次のようなものがある。 水酸化ナトリウム(すいさんかナトリウム) NaOH 水酸化カリウム(すいさんかカリウム KOH 水酸化カルシウム(すいさんかカルシウム) Ca(OH)2 … 石灰水のこと 水酸化バリウム(すいさんかバリウム) Ba(OH)2 アンモニア水 NH3 + H2O … アンモニアの気体が水に溶けたもの 水酸化銅(すいさんかどう) Cu(OH)2 水酸化アルミニウム(すいさんかアルミニウム) Al(OH)3 水酸化鉄(すいさんかてつ) Fe(OH)3 水酸化アンモニウム(すいさんかアンモニウム) NH4OH 炭酸水素ナトリウム(たんさんすいそナトリウム) NaHCO3 |
【アルカリ(塩基)の電離(でんり)】 アルカリは水溶液中では、 陽イオン(よういおん +イオン)と陰イオン(いんいおん -イオン) に分かれている。このことを電離(でんり)という。 主なアルカリは、水の中で次のように分かれている。 NaOH → Na+ + OH- 水酸化ナトリウム ナトリウムイオン 水酸化物イオン KOH → K+ + OH- 水酸化カリウム カリウムイオン 水酸化物イオン Ca(OH)2 → Ca2+ + 2OH- 水酸化カルシウム カルシウムイオン 水酸化物イオン Ba(OH)2 → Ba2+ + 2OH- 水酸化バリウム バリウムイオン 水酸化物イオン NH3 + H20 → NH4+ + OH- アンモニア 水 アンモニウムイオン 水酸化物イオン NH4OH → NH4+ + OH- 水酸化アンモニウム アンモニウムイオン 水酸化物イオン |
【強いアルカリと弱いアルカリ】 すべてのアルカリが上の式のように完全に電離(でんり)しているわけでは ない。一部は電離(でんり)していないものもある。水にとけた分子(ぶんし) の数に対して、電離(でんり)している分子の数の割合を電離度(でんりど) という。完全に電離(でんり)している場合の電離度は1である。 電離度(でんりど)が大きいほど、アルカリを示すOH-(水酸化物イオン)に きちんと分かれていることになり、アルカリを示すOH-(水酸化物イオン)が たくさん水溶液中にあることになる。そのため、電離度が大きいほど強 いアルカリ(強アルカリ)といえ、逆に小さいほど弱いアルカリ(弱アルカリ)というこ とになる。 |
| 酸の名前 | 電離度 | |
| 完全に電離した場合 | 1.00 | |
| 強アルカリ | 水酸化ナトリウム(すいさんかナトリウム) | 0.84 |
| 水酸化カリウム(すいさんかカリウム) | 0.89 | |
| 水酸化カルシウム(すいさんかカルシウム) | 0.90 | |
| 水酸化バリウム(すいさんかバリウム) | 0.80 | |
| 弱アルカリ | 水酸化アンモニウム(すいさんかアンモニウム) | 0.0017 |