酸性とは…
【酸性とは…】 酸の共通な性質を酸性という。 酸は「すっぱい」という意味で、英語のAcidは酢(す)という意味がある。 〈 酸の性質 〉 ① なめるとすっぱい味(酸味 さんみ)がある。 ② 青色リトマス紙を赤色にする。 ③ BTB溶液を黄色にする。 ④ マグネシウムやアルミニウム、亜鉛(あえん)など金属(きんぞく)と 反応して水素を発生させる。 ⑤ 2本の電極(でんきょく)を入れ、電圧を加えると電流が流れる。 ⑥ 植物色素(しきそ)の色を変える。 酸性の水溶液には、必ずH+(水素イオン)がふくまれている。 |
【酸の種類】 酸には主に次のようなものがある。 塩 酸(えんさん) HCl → 水に塩化水素(えんかすいそ)という気体が溶けたもの 硝 酸(しょうさん) HNO3 硫 酸(りゅうさん) H2SO4 炭 酸(たんさん) H2CO3 → 水に二酸化炭素という気体が溶けたもの ホウ酸(ほうさん) H3BO3 亜硫酸(ありゅうさん) H2SO3 酢 酸(さくさん) CH3COOH クエン酸(くえんさん) C6H8O7 … みかんなどにふくまれている酸 酒石酸(しゅせきさん) C4H6O6 … ぶどうにふくまれている酸 リンゴ酸(りんごさん) C4H6O5 … りんごにふくまれている酸 |
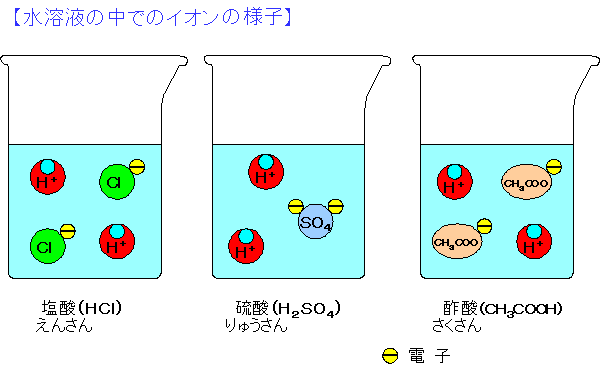
【酸の電離(でんり)】 酸は水溶液中では、 陽イオン(よういおん +イオン)と陰イオン(いんいおん -イオン) に分かれている。このことを電離(でんり)という。 主な酸は、水の中で次のように分かれている。 塩 酸 HCl → H+ + Cl- えんさん 水素イオン 塩化物イオン 硝 酸 HNO3 → H++ NO3- しょうさん 水素イオン 硝酸イオン 硫 酸 H2SO4 → 2H+ + SO42- りゅうさん 水素イオン 硫酸イオン 炭 酸 H2CO3 → 2H+ + CO32- たんさん 水素イオン 炭酸イオン 酢 酸 CH3COOH → H+ + CH3COO- さくさん 水素イオン 酢酸イオン ホウ酸 H3BO3 → 3H++BO33- ほうさん 水素イオン ホウ酸イオン |
【強い酸と弱い酸】 すべての酸が上の式のように完全に電離(でんり)しているわけではない。 一部は電離(でんり)していないものもある。水にとけた分子(ぶんし)の数 に対して、電離(でんり)している分子の数の割合を電離度(でんりど)とい う。完全に電離(でんり)している場合の電離度は1である。 電離度(でんりど)が大きいほど、酸を示すH+(すいそイオン)にきちんと 分かれていることになり、酸を示すH+(すいそイオン)がたくさん水溶液中 にあることになる。そのため、電離度が大きいほど強い酸(強酸)といえ、 逆に小さいほど弱い酸(弱酸)ということになる。 |
| 酸の名前 | 電離度 | |
| 完全に電離した場合 | 1.00 | |
| 強 酸 | 塩酸(えんさん) | 0.92 |
| 硝酸(しょうさん) | 0.92 | |
| 硫酸(りゅうさん) | 0.58 | |
| 弱 酸 | 酢酸(さくさん) | 0.013 |
| 炭酸(たんさん) | 0.0017 |